BICeL - BioImaging Center Lille
La plateforme BioImaging Center Lille (BICeL) regroupe les ressources et expertises en Imagerie cellulaire, tissulaire et du petit animal (rongeur et modèle aquatique), la Cytométrie et l’Imagerie en Flux et les Microscopies Photonique et Electronique.
Les plateaux constitutifs de BICeL sont distribués sur le campus Santé, le campus Pasteur Lille et la Cité Scientifique.
Savoir-faire et services proposés
La plateforme BICeL propose :
- La formation théorique et pratique des utilisateurs des plateaux aux techniques spécifiques,
- L’assistance à la préparation des échantillons et le choix du système approprié à la problématique scientifique,
- L’assistance à l’acquisition des données,
- Aide à l’analyse et l’interprétation des données,
- La prise en charge de toute ou partie d’un projet d’étude (préparation, immuno-marquages, acquisition, analyse des données) dans le cadre des prestations de service.
- En niveau de biosécurité 2 : 1 cytomètre analyseur, 1 cytomètre trieur, 1 spinning disk avec live SR
- Une prestation en restauration d’images par déconvolution 3D
- Une expertise en imagerie intravitale haute résolution du petit animal: un microscope confocal multiphoton (chambre optique et imagerie d’explants) et un imageur petit animal corps entier Lumina XR disponible en animalerie.
Plus d'informations sur le site de la plateforme
Contact : bicel-contactuniv-lillefr
Domaines d'expertise
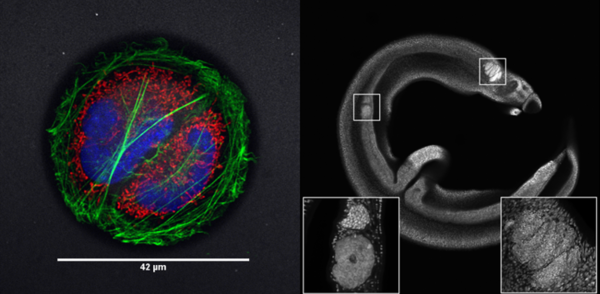
Les plateaux d’imagerie photonique du BICeL mettent à disposition des systèmes optiques variés permettant d’imager les échantillons fixés et/ou vivants aux différentes échelles : molécule, organite, cellule, tissu, organe et organisme entier.
Méthodes proposées :
- Acquisitions multiparamétriques (multi-longueurs d’ondes (acquisition spectrale), multi-positions, au cours du temps, en épaisseur (Z-stack), en mosaïques…)
- Imagerie in vivo du petit animal (explants et chambres optiques), microscopie multi-photonique (en animalerie).
- Imagerie d’organes transparisés, microscopie à feuille de lumière (Ultramicroscope)
- Microscopie virtuelle (scanner de lames)
- Histologie et préparations d’échantillons : automate de coloration, histologie et immuno-marquage, coupes et inclusions.
- Recouvrement de fluorescence après photoblanchiment (FRAP) (Spinning disk)
- Fluorescence par transfert d’énergie (FRET)
- Total Internal Reflection fluorescence (TIRF) (vidéo-microscope)
- Technique de haute résolution : Airy scan, Live SR, et déconvolution (Huygens)
Applications :
- Localisation, suivi et détermination de l’activité de molécules
- Etude dynamique de la distribution d’organites cellulaires
- Dynamique fonctionnelle des interactions moléculaires
- Trafic membranaire
- Survie cellulaire
- Imagerie dans l’épaisseur du tissu (-/+ transparisé)
- Etude longitudinale à long terme en chambre optiques (suivie de la croissance tumorale, tracking de cellules au court du temps).
- Imagerie du petit animal corps entier en bioluminescence, fluorescence et XRay (compatible A2, boitte de confinement)
Les plateaux de microscopie photonique sont également source de conseils pour la mise en place de protocoles de traitements d’images et d’automatisations des analyses via les logiciels :
. ImageJ/Fiji et Icy (développement de macros)
. Imaris (Bitplane) : logiciel de reconstruction et quantification d’images 3-4-5 dimensions.
. Huygens (core): logiciel de déconvolution permettant d’améliorer la résolution et le rapport signal/bruit des images avec comme pré-requis, la connaissance des caractéristiques physiques et optiques du microscope et de l'échantillon.
. Logiciels de visualisation constructeur : Zen, LAS AF, Living image, Incucyte Zoom.
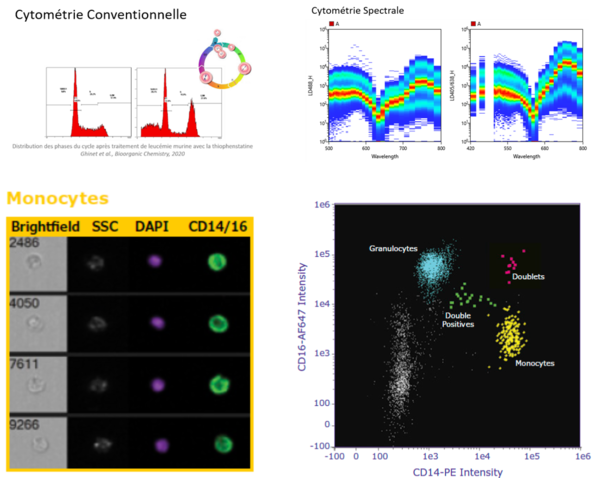
La cytométrie en flux est une technique d’analyse multiparamétrique de particules telles les cellules, bactéries, billes en suspension. Dans le cadre d’une analyse cellulaire, elle peut être utilisée pour la détection de molécules extra et intra-cellulaires et ainsi étudier leurs propriétés structurelles, phénotypiques et/ou fonctionnelles. En complément d’un module de tri cellulaire, de plus amples analyses peuvent être envisagées telles la remise en culture de populations d’intérêt ou encore d’autres analyses de type génomique, protéomique ou transcriptomique sur ces mêmes populations. Par ailleurs, en association avec la microscopie, il est possible également de visualiser par imagerie en flux la fluorescence en parallèle de l’identification et la quantification des populations d’intérêt.
Le plateau propose trois types de cytométrie : la cytométrie conventionnelle, spectrale et acoustique. Le plateau dispose de 6 cytomètres analyseurs, de 3 cytomètres trieurs de cellules et d’un imageur en flux. Le plateau a une expertise nationale sur la détection des évènements rares, la détection des fonctions cellulaires et l’identification des sous-populations de cellules hématopoïétiques et immunitaires.
Le plateau de Microscopie Electronique du BICeL propose un ensemble d’équipements et de compétences permettant la formation, le conseil, la préparation d’échantillons, ainsi que et les observations et analyses par microscopie électronique « en transmission » et « à balayage ».
Applications de la microscopie électronique
En Biologie, chacune des techniques et modalités d’observation employée en microscopie électronique permet d’accéder à des informations spécifiques ou complémentaires permettant de caractériser les échantillons tissulaires ou cellulaires observés, notamment sur le plan dimensionnel, morphologique, structural, fonctionnel, cytochimique.
Certaines techniques additionnelles basées sur des détecteurs (d’électrons ou d’autres rayonnements) ou d’autres dispositifs spécifiques, permettent également d’accéder par exemple à des analyses chimiques à l’échelle microscopique (EDX, EELS), d’autres de faire de la cryo-préparation d’échantillon et de la cryo-observation (en lieu et place d’une préparation chimique, et d’observations, réalisées à température ambiante), ou encore d’envisager des reconstructions 3-D, en collectant des images individuelles à différents angles de rotation ou différentes hauteur l’échantillon (tomographie électronique, 3view serial block, FIB SEM).
Techniques disponibles
- Microscopie électronique en transmission (MET / TEM)
- Microscopie électronique à balayage (MEB / SEM)
- Préparation des échantillons en vue de leur observation et analyse
Méthodes proposées
- Caractérisation morphologique et dimensionnelle
- Cytochimie et immunocytochimie
- Analyse chimique EDX, EELS
- Système de visualisation 3D « 3view »
- Cryo-observation
- Tomographie électronique
- Microscopie corrélative (CLEM)
- Préparation chimique d’échantillons
- Cryopréparation d’échantillons
- Ultramicrotomie
- Coloration négative